Experimentelle Systeme & Methoden
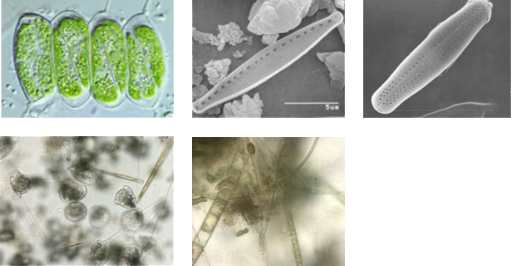
Analyse der akuten und chronischen Wirkungen in Biofilmen, Grünalgen, Cyanobakterien und Kieselalgen
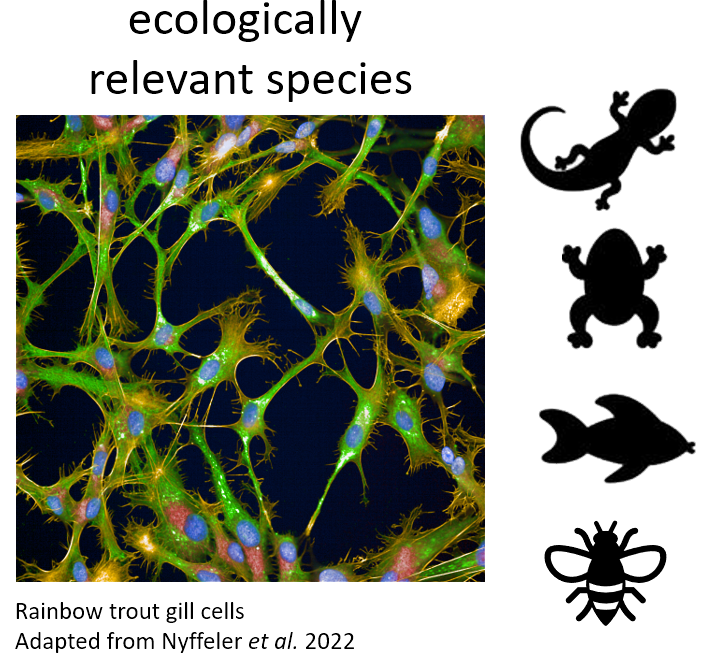
Wir verwenden verschiedene Zelllinien von verschiedenen ökologisch relevanten Arten, darunter Menschen und Fische, für die Erstellung phänotypischer Profile im Hochdurchsatzverfahren.

Wir verwenden verschiedene wirbellose Arten, z. B. Daphnien (Daphnia magna), Gammariden (Gammarus spec.), Stechmücken (Culex pipiens) und Schnecken (Lymnaea stagnalis), um die kurz- und langfristigen Auswirkungen sowie die Anpassung an Mischungen (chemische und/oder nicht-chemische Stressoren) zu bewerten.
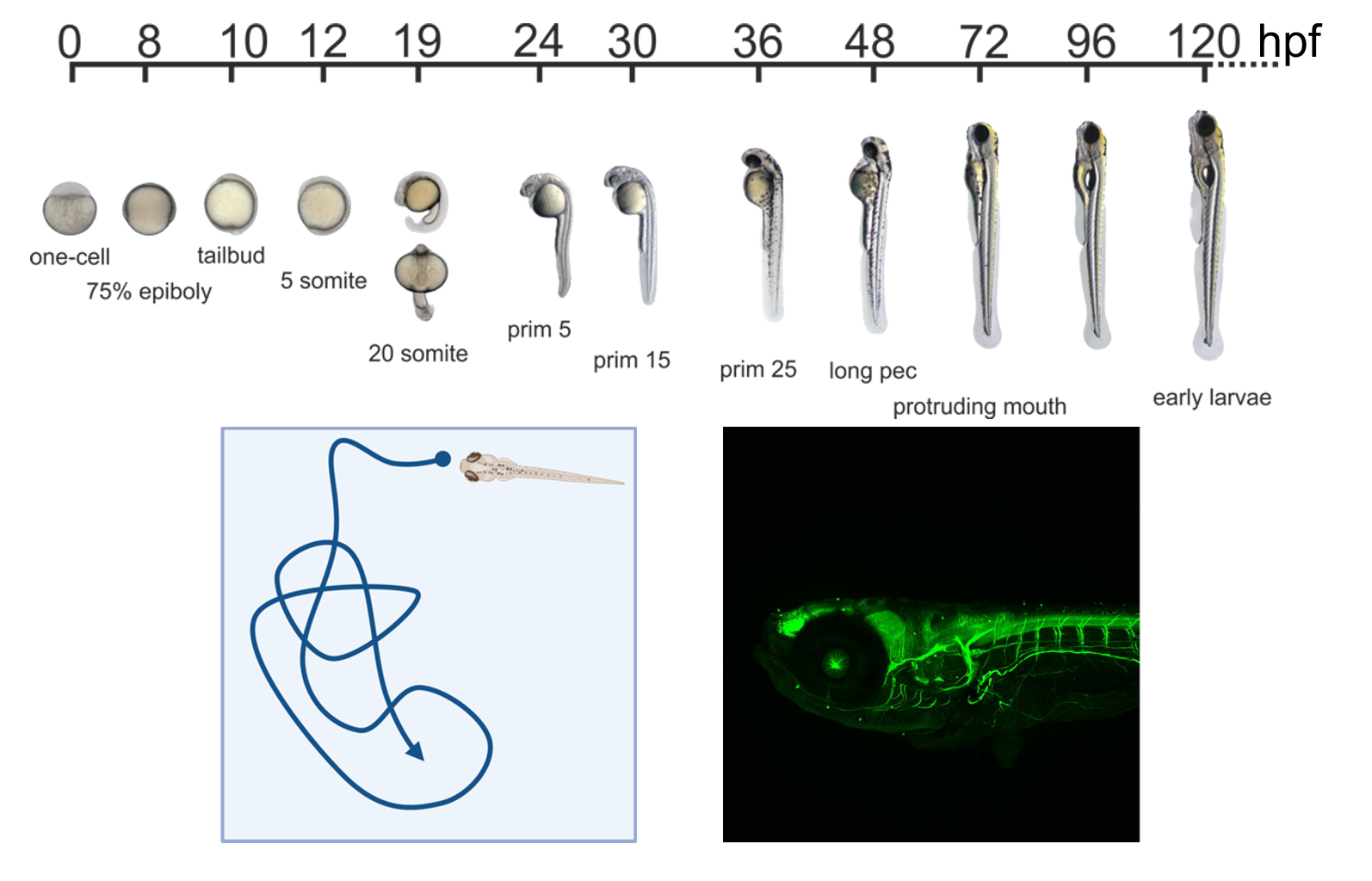
Wir verwenden Zebrabärblings Embryonen als Modellorganismus, da sie sich schnell entwickeln, leicht verfügbar sind und durch ihre vollständige Transparenz eine hochauflösende Beobachtung der Phänotypen ermöglichen.

Messkampagnen, Erfassung von Makroinvertebraten und Verschmutzung, Wasser- und Sedimentproben, kontinuierliche und ereignisbezogene Probenahmen

Wir verfügen über 47 unabhängige künstliche Bäche, die jeweils 14 Meter lang und 0,4 Meter breit sind und einen ökologisch relevanten Aufbau für komplexe experimentelle Forschung bieten. Das Wasser fließt kontinuierlich und ahmt so natürliche kleine Bäche nach. Dadurch wird sichergestellt, dass die Organismen natürliche Verhaltensweisen und ökologische Interaktionen zeigen.

Für Nano- und Mikrokosmosstudien verwenden wir z.B. verschiedene Kulturen von Daphnia magna und Culex pipiens oder auch Kombinationen von höhere Pflanzen und Biofilmen um ihre Reaktionen auf Umweltstressoren zu bewerten.

SPEAR ist als Bioindikator für landwirtschaftliche Pestizide optimiert und zeichnet sich durch typische kurzzeitige Impulsbelastungen in Fließgewässern aus. Zu den berücksichtigten Artenmerkmalen gehören: (i) physiologische Empfindlichkeit gegenüber Insektiziden und anderen Pestiziden mit insektizider Wirkung, (ii) Generationszeit, (iii) Vorhandensein von aquatischen Lebensstadien und (iv) die Fähigkeit zur Migration und Wiederbesiedlung.

Das Verständnis des Einflusses verschiedener Landschaftsparameter auf die Pestizidexposition in Fließgewässern ist wichtig für die Risikobewertung, um Expositionsmodelle zu verbessern und maßgeschneiderte Minderungsstrategien zu entwickeln. Durch die Kombination von Daten aus der Pestizidüberwachung (z. B. aus dem deutschen Kleingewässermonitoring - KgM) mit Informationen über die Landschaft, wie z. B. Einzugsgebietscharakteristika, unter Verwendung von GIS, arbeiten wir an der Validierung bestehender Expositionsmodelle und der Konstruktion neuer statistischer Modelle zur Erklärung und Vorhersage beobachteter Pestizidkonzentrationen.

Wir verwenden ein FACS-System (Fluorescence-Activated Cell Sorting), um die Algen in unseren Proben effizient zu zählen und zu sortieren. Dieses System ermöglicht eine präzise Quantifizierung durch Sortierung und Erkennung von Algen auf der Grundlage von Fluoreszenzmerkmalen und gewährleistet eine genaue Analyse

Wir verwenden HPLC mit DAD (Diodenarray-Detektion) und FLD (Fluoreszenzdetektion) für präzise chemische Analysen. Diese leistungsstarke Kombination ermöglicht eine detaillierte Trennung, Identifizierung und Quantifizierung von Verbindungen und gewährleistet genaue und zuverlässige Ergebnisse in unserer Forschung.

Wir verwenden eine automatisierte Liquid-Handling-Plattform, die für eine präzise, effiziente und skalierbare Probenverarbeitung in verschiedenen Laboranwendungen konzipiert ist.

Wir verwenden eine KI-gestützte automatisierte Bildgebungsplattform, die für die schnelle und inhaltsreiche Analyse biologischer Proben entwickelt wurde.
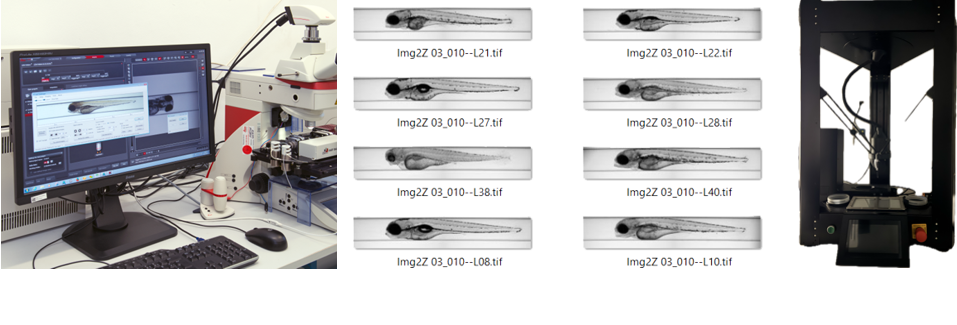
Wir verwenden automatisierte Bildgebungssysteme (AIR und VAST) für die Erstellung von Wirkungsprofilen von Zebrafisch-Embryonen. Dieser fortschrittliche Aufbau ermöglicht eine Bildgebung und Analyse mit hohem Durchsatz, die eine präzise und effiziente Bewertung der morphologischen Effekte einschließlich der Herzfrequenzmessungen ermöglicht.

Wir verwenden ZebraBox-Systeme von ViewPoint für die automatische Analyse des Verhaltens von Zebrafbärblings-Larven. Diese fortschrittliche Plattform ermöglicht eine Hochdurchsatzanalyse der Fortbewegung und der Reaktionen auf Reize und liefert präzise und zuverlässige Verhaltensprofile für unsere Forschung.

Unsere Zebrabärbling-Anlage nutzt das Tecniplast-System zur Unterbringung verschiedener Arten von Wildtypen, transgenen und mutierten Fischen. Das System bietet optimale Haltungsbedingungen für diese tropische Art. Die kontinuierliche Überwachung des pH-Werts, der Temperatur und des Salzgehalts sowie die regelmäßige Kontrolle anderer wichtiger Wasserparameter, in Verbindung mit regelmäßigen Gesundheitskontrollen unserer Fische gewährleisten, dass unsere Forschung mit Zebrabärbling-Embryonen reproduzierbar ist und höchsten wissenschaftlichen Standards entspricht.
