Department Umweltimmunologie
In den vergangenen Jahrzehnten ist die Häufigkeit von Allergien und anderen chronisch entzündlichen Erkrankungen dramatisch angestiegen. Verantwortlich dafür sind u. A. Umweltfaktoren, die zu Fehlregulationen von wichtigen Signalwegen führen und so zur Krankheitsentstehung beitragen. Die zugrunde liegenden Mechanismen sind noch nicht vollständig erforscht. Derartige krankheitsprägende Einflüsse von Umweltbelastungen scheinen vor allem während der perinatalen Phase (sprich in der Schwangerschaft und in der frühen postnatalen Entwicklung) stattzufinden. Doch welche Belastungen sind für wen in welcher Lebensphase kritisch? Und welche molekularen Mechanismen liegen dem zugrunde? Welche Rolle spielen Immunzellen und das Mikrobiom dabei? Diesen wichtigen Fragen widmet sich das Department Ummweltimmunologie am UFZ Leipzig.
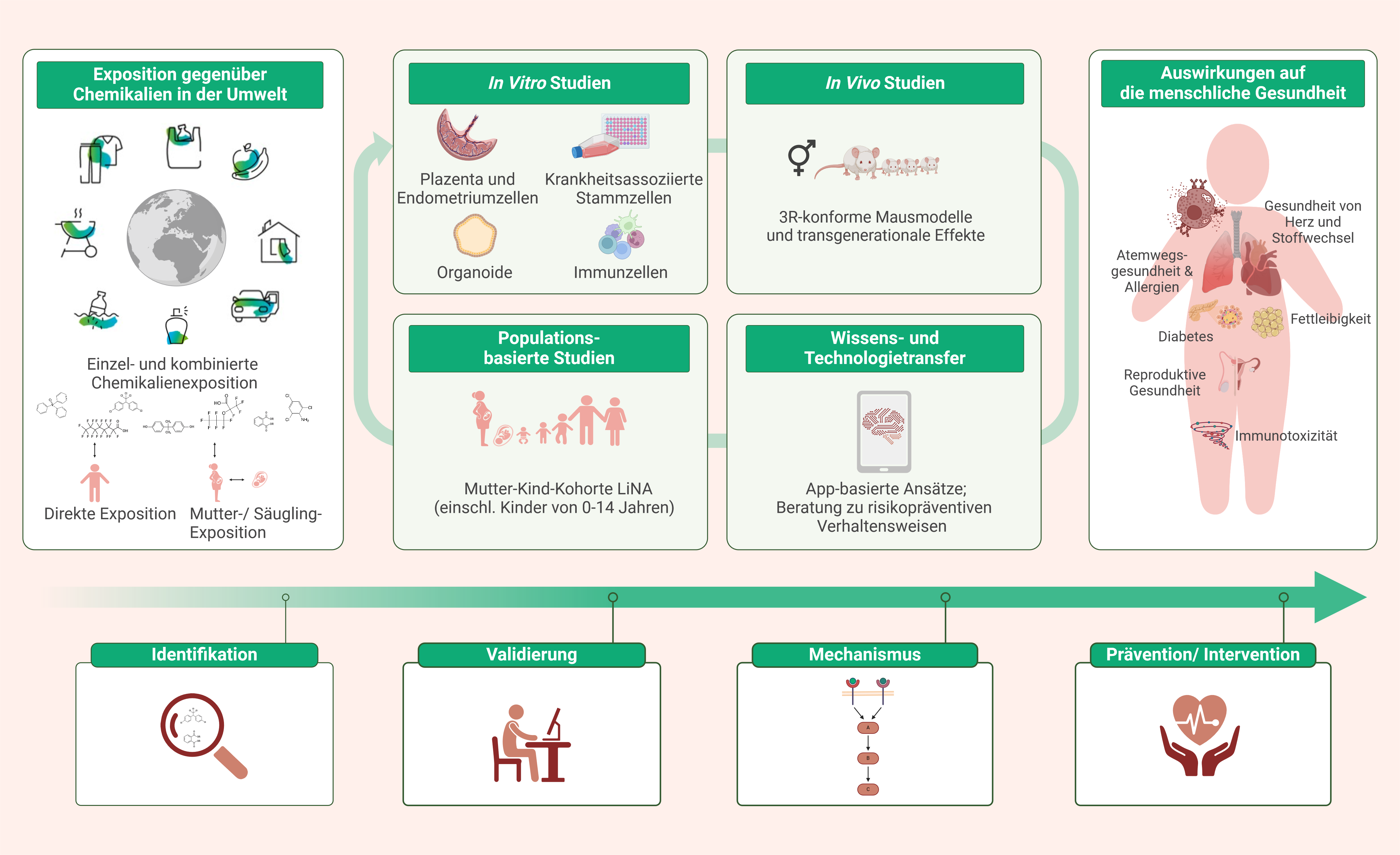
Entscheidend für die Entwicklung von geeigneten Strategien zur Diagnostik und Therapie, insbesondere aber auch zur Prävention von umweltassoziierten Erkrankungen auf individueller Ebene, ist ein umfassendes Verständnis darüber, über welche Mechanismen und in welchen sensiblen Zeitfenstern Umweltfaktoren möglicherweise zur Krankheitsentstehung beitragen können. Dabei ist es wichtig, die gesamte Kette an Ereignissen zu betrachten: von der individuellen komplexen Exposition gegenüber vielfältigen Umweltbelastungen, deren Einfluss auf molekulare Signalwege und zelluläre Funktionen bis hin zu den resultierenden Effekten im Gesamtorganismus.
Die Zeit im mütterlichen Leib ist eine kritische Phase für die Entwicklung und die Plazenta ein außerordentlich wichtiges Organ, welches für die Entstehung von späteren chronischen Krankheiten entscheidend ist. Das adaptive mütterliche Immunsystem ist entscheidend für den Aufbau der Toleranz gegenüber dem Fötus während der Schwangerschaft und für die Aufrechterhaltung des immunologischen Gleichgewichtes zwischen Mutter und Kind. Das angeborene Immunsystem hingegen übernimmt vorrangig Aufgaben bei der Gewebeumwandlung in der Plazenta und sichert somit die ausreichende Nährstoffversorgung des Kindes. Beide Arme des Immunsystems können durch Umweltchemikalien negativ beeinflusst werden und somit das Wachstum des Fötus stören. Das Immunsystem des Ungeborenen wiederum reagiert in der Reifungsphase vor der Geburt sowie in der frühen Kindheit besonders sensibel auf Umweltbelastungen. Unsere Forschungen im Department Umweltimmunologie konzentrieren sich deshalb auf dieses sensible Zeitfenster. Wir nutzen Populations-basierte Kohortenstudien wie die LISAplus-Studie, eine multizentrische deutsche Geburtskohorte, und die LINA-Studie, eine Mutter-Kind-Kohorte, um zu untersuchen, wie Umweltbelastungen und insbesondere Chemikalien in der Prä- und frühen Postnatalphase die Reifung des Immunsystems und die Konsequenzen einer durch Umweltbelastungen veränderten Immunregulation für Erkrankungen später im Leben der Kinder beeinflussen. Liegen aus den Kohortenstudien Hinweise auf Erkrankungsrisiken durch bestimmte Chemikalien oder Schadstoffe vor, werden zellbasierte und in-vitro-Modelle eingesetzt, um die zugrunde liegenden molekularen Mechanismen aufzuklären und fehlregulierte Signalwege zu identifizieren. Weiterhin nutzen wir komplexe in-vivo-Modelle, um den Einfluss von Umweltbelastungen auf physiologische Mechanismen bis hin zu Krankheitsentstehung auch generationsübertragend zu erforschen. Diese Modelle dienen vor allem dazu, die molekularen Mechanismen zu verstehen und Möglichkeiten für Prävention und Therapie zu testen.
Die Identifizierung von gesundheitsschädigenden Umweltbelastungen und die Aufklärung der zugrunde liegenden molekularen Mechanismen liefern die wissenschaftliche Grundlage für die Entwicklung von neuen, effizienteren diagnostischen und therapeutischen Ansätzen sowie individuell basierten Präventionsstrategien. Durch den Fokus auf insbesondere chemikalienbedingte Gesundheitseffekte unterstützen wir die UFZ-Strategie einer integrierten Risikobewertung von Chemikalien im Hinblick auf Risiken für Mensch und Ökosystem.
Neuste Publikationen
Inhalt:
Weiterführende Recherchen können Sie in unserem Publikationsverzeichnis durchführen.
2023 (30)
- Ayuk, H.S., Arnold, S., Bauer, M., Stadtmüller, M., Lindemann, D., Stojanovska, V., Zenclussen, A. (2023):
Entry points for SARS-CoV-2 in trophoblast cells and possible mechanisms of resistance
Placenta 140 , e53 10.1016/j.placenta.2023.07.176 - Bauer, M. (2023):
Interplay between toxicants, natural toxins, and the immune system in animal models. Editorial
Front. Immunol. 14 , art. 1186300 10.3389/fimmu.2023.1186300 - Buchenauer, L., Haange, S.-B., Bauer, M., Rolle-Kampczyk, U.E., Wagner, M., Stucke, J., Elter, E., Fink, B., Vass, M., von Bergen, M., Schulz, A., Zenclussen, A.C., Junge, K.M., Stangl, G.I., Polte, T. (2023):
Maternal exposure of mice to glyphosate induces depression- and anxiety-like behavior in the offspring via alterations of the gut-brain axis
Sci. Total Environ. 905 , art. 167034 10.1016/j.scitotenv.2023.167034 - Fischer, F., Ermer, M.R., Howanski, J., Zenclussen, A.C., Schumacher, A. (2023):
Bisphenol A and benzophenone-3, two ubiquitous endocrine disruptors, may interfere with tolerance pathways by disturbing the T cell equilibrium
Am. J. Reprod. Immunol. 89 (S1), 83 - 83 10.1111/aji.13696 - Fischer, F., Zenclussen, A.C., Meyer, N. (2023):
Gefährdung durch Alltagschemikalien: Ein Impuls für die Schwangerschaftsvorsorge. Hazards due to everyday chemicals: An impulse for prenatal care
Gynäkologie 56 (9), 633 - 640 10.1007/s00129-023-05125-6 - Hofsink, N., Dijkstra, D.J., Stojanovska, V., Scherjon, S.A., Plösch, T. (2023):
Preeclampsia-induced alterations in brain and liver gene expression and DNA methylation patterns in fetal mice
J. Dev. Orig. Health Dis. 14 (1), 146 - 151 10.1017/S2040174422000344 - Junge, K.M., Zenclussen, A.C., Desoye, G. (2023):
(Über‑)Ernährung und Einfluss auf die Funktion der Plazenta
Diabetologie 19 (6), 747 - 757 10.1007/s11428-023-01087-4 - Kadalayil, L., Alam, M., White, C.H., Ghantous, A., Walton, E., Gruzieva, O., Merid, S.K., Kumar, A., Roy, R., Solomon, O., Huen, K., Eskenazi, B., Rzehak, P., Grote, V., Langhendries, J.-P., Verduci, E., Ferre, N., Gruszfeld, D., Gao, L., Guan, W., Zeng, X., Schisterman, E.F., Dou, J., Bakulski, K.M., Feinberg, J.I., Soomro, M.H., Pesce, G., Baiz, N., Isaevska, E., Plusquin, M., Vafeiadi, M., Roumeliotaki, T., Langie, S.A.S., Standaert, A., Allard, C., Perron, P., Bouchard, L., van Meel, E.R., Felix, J.F., Jaddoe, V.W.V., Yousefi, P.D., Ramlau‑Hansen, C.H., Relton, C.L., Tobi, E.W., Starling, A.P., Yang, I.V., Llambrich, M., Santorelli, G., Lepeule, J., Salas, L.A., Bustamante, M., Ewart, S.L., Zhang, H., Karmaus, W., Röder, S., Zenclussen, A.C., Jin, J., Nystad, W., Page, C.M., Magnus, M., Jima, D.D., Hoyo, C., Maguire, R.L., Kvist, T., Czamara, D., Räikkönen, K., Gong, T., Ullemar, V., Rifas‐Shiman, S.L., Oken, E., Almqvist, C., Karlsson, R., Lahti, J., Murphy, S.K., Håberg, S.E., London, S., Herberth, G., Arshad, H., Sunyer, J., Grazuleviciene, R., Dabelea, D., Steegers‑Theunissen, R.P.M., Nohr, E.A., Sørensen, T.I.A., Duijts, L., Hivert, M.-F., Nelen, V., Popovic, M., Kogevinas, M., Nawrot, T.S., Herceg, Z., Annesi‑Maesano, I., Fallin, M.D., Yeung, E., Breton, C.V., Koletzko, B., Holland, N., Melén, E., Sharp, G.C., Silver, M.J., Rezwan, F.I., Holloway, J.H. (2023):
Analysis of DNA methylation at birth and in childhood reveals changes associated with season of birth and latitude
Clin. Epigenetics 15 , art. 148 10.1186/s13148-023-01542-5 - Kilanowski, A., Thiering, E., Wang, G., Kumar, A., Kress, S., Flexeder, C., Bauer, C.-P., Berdel, D., von Berg, A., Bergström, A., Gappa, M., Heinrich, J., Herberth, G., Koletzko, S., Kull, I., Melen, E., Schikowski, T., Peters, A., Standl, M. (2023):
Allergic disease trajectories up to adolescence: Characteristics, early-life, and genetic determinants
Allergy 78 (3), 836 - 850 10.1111/all.15511 - Kotsakis Ruehlmann, A., Sammallahti, S., Cortés Hidalgo, A.P., Bakulski, K.M., Binder, E.B., Campbell, M.L., Caramaschi, D., Cecil, C., Colicino, E., Cruceanu, C., Czamara, D., Dieckmann, L., Dou, J., Felix, J.F., Frank, J., Håberg, S.E., Herberth, G., Hoang, T.T., Houtepen, L.C., Hüls, A., Koen, N., London, S.J., Magnus, M.C., Mancano, G., Mulder, R.H., Page, C.M., Räikkönen, K., Röder, S., Schmidt, R.J., Send, T.S., Sharp, G., Stein, D.J., Streit, F., Tuhkanen, J., Witt, S.H., Zar, H.J., Zenclussen, A.C., Zhang, Y., Zillich, L., Wright, R., Lahti, J., Brunst, K.J. (2023):
Epigenome-wide meta-analysis of prenatal maternal stressful life events and newborn DNA methylation
Mol. Psychiatr. 28 , 5090 - 5100 10.1038/s41380-023-02010-5 - Krause, J.L., Pierzchalski, A., Chang, H.D., Zenclussen, A.C., Bauer, M., Herberth, G. (2023):
Bisphenols, but not phthalate esters, modulate gene expression in activated human MAIT cells in vitro
Toxicol. Rep. 10 , 348 - 356 10.1016/j.toxrep.2023.02.017 - Kretschmer, T., Fischer, F., Seifert, P., Schumacher, A., Kass, L., Rodríguez, H.A., Zenclussen, M.L., Zenclussen, A.C. (2023):
Intrauterine exposure to bisphenol A and benzophenone-3 affects fetal growth and impacts on uterine innate immune cells supporting pregnancy
Am. J. Reprod. Immunol. 89 (S1), 82 - 83 10.1111/aji.13696 - Maddalon, A., Pierzchalski, A., Kretschmer, T., Bauer, M., Zenclussen, A.C., Marinovich, M., Corsini, E., Herberth, G. (2023):
Mixtures of per- and poly-fluoroalkyl substances (PFAS) reduce the in vitro activation of human T cells and basophils
Chemosphere 336 , art. 139204 10.1016/j.chemosphere.2023.139204 - Meyer, N., Hinz, N., Schumacher, A., Weißenborn, C., Fink, B., Bauer, M., von Lenthe, S., Ignatov, A., Fest, S., Zenclussen, A.C. (2023):
Mast cells retard tumor growth in ovarian cancer: insights from a mouse model
Cancers 15 (17), art. 4278 10.3390/cancers15174278 - Musiol, S., Harris, C.P., Karlina, R., Gostner, J.M., Rathkolb, B., Schnautz, B., Schneider, E., Mair, L., Elorduy Vergara, E., Flexeder, C., Koletzko, S., Bauer, C.-P., Schikowski, T., Berdel, D., von Berg, A., Herberth, G., Rozman, J., Hrabe de Angelis, M., Standl, M., Schmidt-Weber, C.B.., Ussar, S., Alessandrini, F. (2023):
Dietary digestible carbohydrates are associated with higher prevalence of asthma in humans and with aggravated lung allergic inflammation in mice
Allergy 78 (5), 1218 - 1233 10.1111/all.15589 - Pfannes, R., Pierzchalski, A., Maddalon, A., Simion, A., Zouboulis, C.C., Behre, G., Zenclussen, A.C., Westphal, S., Fest, S., Herberth, G. (2023):
Characterization of post-vaccination SARS-CoV-2 T cell subtypes in patients with different hematologic malignancies and treatments
Front. Immunol. 14 , art. 1087996 10.3389/fimmu.2023.1087996 - Pierzchalski, A., Zenclussen, A.C., Herberth, G. (2023):
OMIP-94: Twenty-four-color (thirty-marker) panel for deep immunophenotyping of immune cells in human peripheral blood
Cytom. Part A 103 (9), 695 - 702 10.1002/cyto.a.24766 - Polte, T. (2023):
Early-live exposure to endocrine disrupting chemicals affects the development of asthma or overweight in the offspring: role of epigenetic alterations
Toxicol. Lett. 384 (Suppl. 1), S42 - S42 10.1016/S0378-4274(23)00371-5 - Prokopciuk, N., Juskiene, I., Tarasiuk, N., Franck, U., Kostiuk, O., Valiulis, A., Taminskiene, V., Valiulis, A. (2023):
On the additional risk for human health in the use of sandblasting of building walls
Environ. Sci. Pollut. Res. 30 (19), 56558 - 56568 10.1007/s11356-023-26382-x - Raab, J., Fink, B., Bauer, M. (2023):
Appearance of ghost bands in gel electrophoresis depending on agarose concentration
Electrophoresis 44 (15-16), 1206 - 1209 10.1002/elps.202300041 - Röder, S. (2023):
PatternMatchR: a tool for matching and visualiszation of omics patterns
Version: v0.2.3 Zenodo 10.5281/zenodo.8138916 - Romanelli, F., Zenclussen, M.L., Zenclussen, A.C., Meyer, N. (2023):
Carbon monoxide exposure does not improve the in vitro fertilization rate of oocytes obtained from heterozygous Hmox1 knockout mice
Int. J. Fertil. Steril. 18 (1), 76 - 80 10.22074/ijfs.2023.1982726.1411 - Schulz, J., Schilling, E., Fabian, C., Zenclussen, A.C., Stojanovska, V., Claus, C. (2023):
Dissecting rubella placental infection in an in vitro trophoblast model
Int. J. Mol. Sci. 24 (9), art. 7894 10.3390/ijms24097894 - Thiering, E., Markevych, I., Kress, S., Astell-Burt, T., Feng, X., Altug, H., Koletzko, S., Bauer, C.-P., von Berg, A., Berdel, D., Herberth, G., Schikowski, T., Heinrich, J., Standl, M. (2023):
Gene-environment interaction in the association of residential greenness and 25(OH) vitamin D
Environ. Pollut. 327 , art. 121519 10.1016/j.envpol.2023.121519 - Thürmann, L., Bauer, M., Ferland, M., Messingschlager, M., Schikowski, T., von Berg, A., Heinrich, J., Herberth, G., Lehmann, I., Standl, M., Trump, S. (2023):
Undiagnosed pediatric elevated blood pressure is characterized by induction of proinflammatory and cytotoxic mediators
Hypertension 80 (11), 2425 - 2436 10.1161/HYPERTENSIONAHA.123.21489 - Thürmann, L., Klös, M., Mackowiak, S.D., Bieg, M., Bauer, T., Ishaque, N., Messingschlager, M., Herrmann, C., Röder, S., Bauer, M., Schäuble, S., Faessler, E., Hahn, U., Weichenhan, D., Mücke, O., Plass, C., Borte, M., von Mutius, E., Stangl, G.I., Lauener, R., Karvonen, A.M., Divaret-Chauveau, A., Riedler, J., Heinrich, J., Standl, M., von Berg, A., Schaaf, B., Herberth, G., Kabesch, M., Eils, R., Trump, S., Lehmann, I. (2023):
Global hypomethylation in childhood asthma identified by genome-wide DNA-methylation sequencing preferentially affects enhancer regions
Allergy 78 (6), 1489 - 1506 10.1111/all.15658 - Uehre, G.M., Tchaikovski, S., Ignatov, A., Zenclussen, A.C., Busse, M. (2023):
B cells induce early-onset maternal inflammation to protect against LPS-induced fetal rejection
Int. J. Mol. Sci. 24 (22), art. 16091 10.3390/ijms242216091 - Wang, M., Flexeder, C., Kilanowski, A., Kress, S., Herberth, G., Schikowski, T., Peters, A., Standl, M. (2023):
Changes in sleep duration and sleep difficulties from adolescence to young adulthood and the risk of obesity: Bidirectional evidence in the GINIplus and LISA studies
Sleep Med. 101 , 401 - 410 10.1016/j.sleep.2022.11.031 - Yin, Z., Schumacher, A., Zenclussen, A.C. (2023):
Sex-specific effect of bisphenol A, its substitutes and benzophenone-3 on T helper 1 cell differentiation
Am. J. Reprod. Immunol. 89 (S1), 83 - 84 10.1111/aji.13696 - Zenclussen, A. (2023):
Understanding B cell-mediated immune mechanisms underlying pre-term birth (or pregnancy complications) and their relevance for intervention strategies
Placenta 140 , e20 - e21 10.1016/j.placenta.2023.07.080
Inhalt:
Weiterführende Recherchen können Sie in unserem Publikationsverzeichnis durchführen.
2024 (12)
- Choudhary, P., Monasso, G.S., Karhunen, V., Ronkainen, J., Mancano, G., Howe, C.G., Niu, Z., Zeng, X., Guan, W., Dou, J., Feinberg, J.I., Mordaunt, C., Pesce, G., Baïz, N., Alfano, R., Martens, D.S., Wang, C., Isaevska, E., Keikkala, E., Mustaniemi, S., Thio, C.H.L., Fraszczyk, E., Tobi, E.W., Starling, A.P., Cosin-Tomas, M., Urquiza, J., Röder, S., Hoang, T.T., Page, C., Jima, D.D., House, J.S., Maguire, R.L., Ott, R., Pawlow, X., Sirignano, L., Zillich, L., Malmberg, A., Rauschert, S., Melton, P., Gong, T., Karlsson, R., Fore, R., Perng, W., Laubach, Z.M., Czamara, D., Sharp, G., Breton, C.V., Schisterman, E., Yeung, E., Mumford, S.L., Fallin, M.D., LaSalle, J.M., Schmidt, R.J., Bakulski, K.M., Annesi-Maesano, I., Heude, B., Nawrot, T.S., Plusquin, M., Ghantous, A., Herceg, Z., Nisticò, L., Vafeiadi, M., Kogevinas, M., Vääräsmäki, M., Kajantie, E., Snieder, H., Corpeleijn, E., Steegers-Theunissen, R.P.M., Yang, I.V., Dabelea, D., Fossati, S., Zenclussen, A.C., Herberth, G., Magnus, M., Håberg, S.E., London, S.J., Munthe-Kaas, M.C., Murphy, S.K., Hoyo, C., Ziegler, A.-G., Hummel, S., Witt, S.H., Streit, F., Frank, J., Räikkönen, K., Lahti, J., Huang, R.-C., Almqvist, C., Hivert, M.-F., Jaddoe, V.W.V., Järvelin, M.-R., Kantomaa, M., Felix, J.F., Sebert, S. (2024):
Maternal educational attainment in pregnancy and epigenome-wide DNA methylation changes in the offspring from birth until adolescence
Mol. Psychiatr. 29 , 348 - 358 10.1038/s41380-023-02331-5 - Fischer, F., Ermer, M.R., Howanski, J., Yin, Z., Bauer, M., Wagner, M., Fink, B., Zenclussen, A.C., Schumacher, A. (2024):
Single and mixture effects of bisphenol A and benzophenone-3 on in vitro T helper cell differentiation
Chem.-Biol. Interact. 395 , art. 111011 10.1016/j.cbi.2024.111011 - Fischer, F., Kretschmer, T., Seifert, P., Howanski, J., Krieger, E., Rödiger, J., Fink, B., Yin, Z., Bauer, M., Zenclussen, M.L., Meyer, N., Schumacher, A., Zenclussen, A.C. (2024):
Single and combined exposures to bisphenol A and benzophenone-3 during early mouse pregnancy have differential effects on fetal and placental development
Sci. Total Environ. 922 , art. 171386 10.1016/j.scitotenv.2024.171386 - Fischer, F., Pierzchalski, A., Riesbeck, S., Aldehoff, A.S., Castañeda-Monsalve, V., Haange, S.-B., von Bergen, M., Rolle-Kampczyk, U.E., Jehmlich, N., Zenclussen, A.C., Herberth, G. (2024):
An in vitro model system for testing chemical effects on microbiome-immune interactions - examples with BPX and PFAS mixtures
Front. Immunol. 15 , art. 1298971 10.3389/fimmu.2024.1298971 - Junge, K. (2024):
Early lifestyle and environmental factors and their impact on infant allergy & obesity development
[Keine Auswahl]
Martin-Luther-Universität Halle-Wittenberg, Naturwissenschaftliche Fakultät III - Agrar- und Ernährungswissenschaften, Geowissenschaften und Informatik, Halle/S., 10.25673/116209 - Krause, J.L., Engelmann, B., Schaepe, S.S., Rolle-Kampczyk, U., Jehmlich, N., Chang, H.-D., Slanina, U., Hoffmann, M., Lehmann, J., Zenclussen, A.C., Herberth, G., von Bergen, M., Haange, S.-B. (2024):
DSS treatment does not affect murine colonic microbiota in absence of the host
Gut Microbes 16 (1), art. 2297831 10.1080/19490976.2023.2297831 - Li, S., Spitz, N., Ghantous, A., Abrishamcar, S., Reimann, B., Marques, I., Silver, M.J., Aguilar-Lacasaña, S., Kitaba, N., Rezwan, F.I., Röder, S., Sirignano, L., Tuhkanen, J., Mancano, G., Sharp, G.C., Metayer, C., Morimoto, L., Stein, D.J., Zar, H.J., Alfano, R., Nawrot, T., Wang, C., Kajantie, E., Keikkala, E., Mustaniemi, S., Ronkainen, J., Sebert, S., Silva, W., Vääräsmäki, M., Jaddoe, V.W.V., Bernstein, R.M., Prentice, A.M., Cosin-Tomas, M., Dwyer, T., Håberg, S.E., Herceg, Z., Magnus, M.C., Munthe-Kaas, M.C., Page, C.M., Völker, M., Gilles, M., Send, T., Witt, S., Zillich, L., Gagliardi, L., Richiardi, L., Czamara, D., Räikkönen, K., Chatzi, L., Vafeiadi, M., Arshad, S.H., Ewart, S,, Plusquin, M., Felix, J.F., Moore, S.E., Vrijheid, M., Holloway, J.W., Karmaus, W., Herberth, G., Zenclussen, A., Streit, F., Lahti, J., Hüls, A., Hoang, T.T., London, S.J., Wiemels, J.L. (2024):
A Pregnancy and Childhood Epigenetics Consortium (PACE) meta-analysis highlights potential relationships between birth order and neonatal blood DNA methylation
Commun. Biol. 7 , art. 66 10.1038/s42003-023-05698-x - Maddalon, A., Pierzchalski, A., Krause, J.L., Bauer, M., Finckh, S., Brack, W., Zenclussen, A.C., Marinovich, M., Corsini, E., Krauss, M., Herberth, G. (2024):
Impact of chemical mixtures from wastewater treatment plant effluents on human immune cell activation: An effect-based analysis
Sci. Total Environ. 906 , art. 167495 10.1016/j.scitotenv.2023.167495 - Pierzchalski, A., Zenclussen, A.C., Herberth, G. (2024):
A comprehensive battery of flow cytometric immunoassays for the in vitro testing of chemical effects in human blood cells
Front. Immunol. 14 , art. 1327960 10.3389/fimmu.2023.1327960 - Schierano-Marotti, G., Altamirano, G.A., Oddie, S., Gomez, A.L., Meyer, N., Muñoz-de-Toro, M., Zenclussen, A.C., Rodríguez, H.A., Kass, L. (2024):
Branching morphogenesis of the mouse mammary gland after exposure to benzophenone-3
Toxicol. Appl. Pharmacol. 484 , art. 116868 10.1016/j.taap.2024.116868 - Snapkow, I., Smith, N.M., Arnesdotter, E., Beekmann, K., Blanc, E.B., Braeuning, A., Corsini, E., Sollner Dolenc, M., Duivenvoorde, L.P.M., Eriksen, G.S., Franko, N., Galbiati, V., Gostner, J.M., Grova, N., Gutleb, A.C., Hargitai, R., Janssen, A.W.F., Krapf, S.A., Lindeman, B., Lumniczky, K., Maddalon, A., Mollerup, S., Parráková, L., Pierzchalski, A., Pieters, R.H.H., Silva, M.J., Solhaug, A., Staal, Y.C.M., Straumfors, A., Szatmári, T., Turner, J.D., Vandebriel, R.J., Zenclussen, A.C., Barouki, R. (2024):
New approach methodologies to enhance human health risk assessment of immunotoxic properties of chemicals - a PARC (Partnership for the Assessment of Risk from Chemicals) project
Front. Toxicol. 6 , art. 1339104 10.3389/ftox.2024.1339104 - Zenclussen, M.L., Ulrich, S., Bauer, M., Fink, B., Zenclussen, A.C., Schumacher, A., Meyer, N. (2024):
Absence of heme oxygenase-1 affects trophoblastic spheroid implantation and provokes dysregulation of stress and angiogenesis gene expression in the uterus
Cells 13 (5), art. 376 10.3390/cells13050376
