Technologieentwicklung und Implementierung
Die Entwicklung von neuen, innovativen Technologien und Konzepten auf dem Gebiet der Wasserwirtschaft bildet einen Kernbestandteil des IWAS-Projektes, insbesondere mit Blick auf die Stärkung der Wettbewerbsfähigkeit deutscher Unternehmen im internationalen Maßstab.
Im Rahmen des Arbeitspakets Technologieentwicklung und Implementierung
wird dafür die Entwicklung neuer Technologien mit zwei Schwerpunkten verfolgt: die Hydrothermale Carbonisierung mit besonderer Ausrichtung auf das Sewchar-Konzept und Aptamer-basierte Multisensorsysteme.
Hydrothermale Carbonisierung (HTC) und Sewchar-Konzept:
Beitrag nicht nur zum Klimaschutz und zur Sicherung der Energie- und Nahrungsmittelversorgung sondern auch zum Gesundheits- und Umweltschutz leisten. Die UFZ-Departments UBZ und TUCHEM behandeln sowohl konversionstechnologische als auch anwendungsorientierte Arbeiten zum Sewchar-Konzept. Während pyrolyseähnliche Verfahren wie z.B. die thermokatalytische Niedertemperaturkonvertierung (NTK) auf die Behandlung trockener bzw. vorgetrockneter Ausgangsmaterialien abzielen, erlaubt die Hydrothermale Carbonisierung (HTC) eine direkte Konversion auch sehr wasserreicher Substrate. Daher erscheint die HTC für den Einsatz in Sewchar-Systemen in besonderer Weise geeignet.
Bei der HTC werden komplexe Biomassen (z.B. Gärrückstände, Maissilage, Humanexkremente, Klärschlämme und sonstige biogene Rückstände) in wässriger Lösung oder Suspension in Biokohlen umgewandelt. Anders als die bekannten trockenen Pyrolyseverfahren verläuft die HTC-Reaktion exotherm. Die festen Konversionsprodukte können konzeptionell nicht nur als Sewchars für die Aufwertung und Kohlenstoffsequestrierung von Böden sondern auch als hochwertiger Brennstoff verwendet werden. Die HTC-Technologie ist noch nicht Stand der Technik. Bisher bestehen nur wenige kleintechnische Versuchsanlagen. Deutschland hat sich an die Spitze der technischen Entwicklung der HTC und der Forschung zur Verwertung der Konversionsprodukte gesetzt. Effekte von HTC-Chars auf den Boden und das Pflanzenwachstum sind bisher ungenügend untersucht. Deren Kenntnis ist eine wichtige Voraussetzung für die Einbeziehung der HTC in Sewchar-Systeme.
Aptamer-basierte Multisensorsysteme:
Die schnelle, einfache und kostengünstige Detektion von pathogenen Mikroorganismen im Trink- und Abwasser ist weltweit und insbesondere in wasserarmen Regionen unter dem Aspekt des Abwasserrecyclings eine ungelöste Fragestellung.
Ziel des Projektes ist die Entwicklung eines Multisensorsystems auf der Basis von Aptameren zum Nachweis pathogener Verunreinigungen (insbesondere bakterielle Pathogene) in Wässern und somit die Bereitstellung eines Instrumentes zur schnellen hygienischen Beurteilung von Wasserqualität am Standort.
Das Projekt beinhaltet zwei grundlegende Herausforderungen. Die wissenschaftliche Herausforderung besteht in der Bereitstellung pathogenspezifischer Aptamere, die als biologische Erkennungselemente im Multisensorsystem eingesetzt werden sollen. Aptamere sind hoch affine Nukleinsäuremoleküle, die aufgrund ihrer dreidimensionalen Struktur ihr Target nach dem Schlüssel-Schloss-Prinzip spezifisch erkennen und binden können. Ähnlich wie Antikörper sind sie damit hervorragend auch für analytische Anwendungen geeignet. Aptamere werden mittels der SELEX-Technologie, einer in vitro Selektions- und Amplifikationsmethode, aus einer hoch komplexen, randomisierten Oligonukleotid-Bibliothek (~1015 verschiedene Oligonukleotide) für ein vorgegebenes Target selektiert und angereichert. Dies beinhaltet das wiederholte Durchlaufen sogenannter SELEX-Runden, wobei jede Runde die Schritte Selektion (Bindung, Waschen, Elution), Amplifikation und Reinigung umfasst. Im Anschluss werden der selektierte Aptamer-Pool kloniert und mehrere individuelle Aptamer-Klone umfassend charakterisiert (Sequenzierung, Sequenzanalyse, Bindungsstudien zur Affinität und Spezifität, Testung in verschiedenen Assayformaten, Modifizierung und Optimierung der Aptamersequenz). Die Nutzung der SELEX-Technologie zur Selektion von Aptameren für bakterielle Pathogene und die umweltanalytische Anwendung dieser Aptamere zur Detektion der Pathogene in Umweltproben ist ein neues Gebiet der Aptamerforschung.
Die technologische Herausforderung im Projekt besteht in der messtechnischen Konzipierung eines kompakten, portablen SPR-basierten Sensorsystems für die Vor-Ort-Analytik. Das SPR-Prinzip (Surface Plasmon Resonance) ermöglicht einen markierungsfreien Nachweis biomolekularer Interaktionen, wie z. B. die Bindung zwischen Aptamer und Target. Durch den Aufbau des Sensorsystems als Mehrkanalsystem soll außerdem die Voraussetzung für eine parallele Messung verschiedener Targets geschaffen werden.
In den ersten Schritten des Projektes erfolgte zunächst eine Auswahl relevanter bakterieller Pathogene, die in Wässern vorkommen und ein Risiko für die menschliche Gesundheit darstellen. Zu ihnen zählen Escherichia coli, Salmonella typhimurium, Staphylococcus aureus, Listeria monocytogenes und Campylobacter jejuni. Um Aptamere für bakterielle Pathogene zu selektieren gibt es prinzipiell zwei Herangehensweisen: definierte Targetmoleküle und komplexe Targetstrukturen. Beide Herangehensweisen wurden im Projekt verfolgt. Als Ergebnis konnte am UFZ bereits ein Aptamer-Pool für Protein A von St. aureus nach 11 SELEX-Runden selektiert werden. Die für Protein A selektierten Aptamersequenzen sind Gegenstand einer laufenden Patentanmeldung. Parallel dazu sind die SELEX-Prozesse, in denen Bakterienzellen als Selektionstarget eingesetzt wurden, am UFZ weit fortgeschritten. Der nächste Schritt wird hier jeweils die Klonierung des nach mehreren SELEX-Runden erhaltenen Oligonukleotid-Pools sein.
Parallel zu den Arbeiten der Selektion pathogenspezifischer Aptamere wurde am Fraunhofer IWS (Dresden) an der Konzipierung eines kompakten, portablen SPR-basierten Sensorsystems gearbeitet und ein erster Laborprototyp entwickelt, welcher die Basis des im Projekt geplanten Multisensorsystems bildet. Das Surface Plasmon Resonance (SPR) Prinzip arbeitet markierungsfrei und ist damit auch sehr gut geeignet für die Echtzeit-Beobachtung von biomolekularen Wechselwirkungen mittels entsprechender Affinitätssensoren (kommerziell z. B. Biacore). Die Basis für den Nachweis eines Analyten in Lösung, z. B. bakterielle Pathogene, bilden Analyt-spezifische, biologische Erkennungselemente, z. B. Aptamere, die auf einem mit einem Goldfilm beschichteten Sensorchip immobilisiert werden. Die Interaktion zwischen Analyt und Aptamer findet in einer Flusszelle auf der Sensoroberfläche statt. Durch die Anbindung des Analyten an das Aptamer kommt es zu einem Massezuwachs in der Sensorschicht, welcher zu einer Änderung des Brechungsindexes dieser Schicht führt. Diese Änderung des Brechungsindexes wird als messbares Signal ausgegeben und ist proportional zu der Menge an gebundenem Analyten auf der Sensoroberfläche.
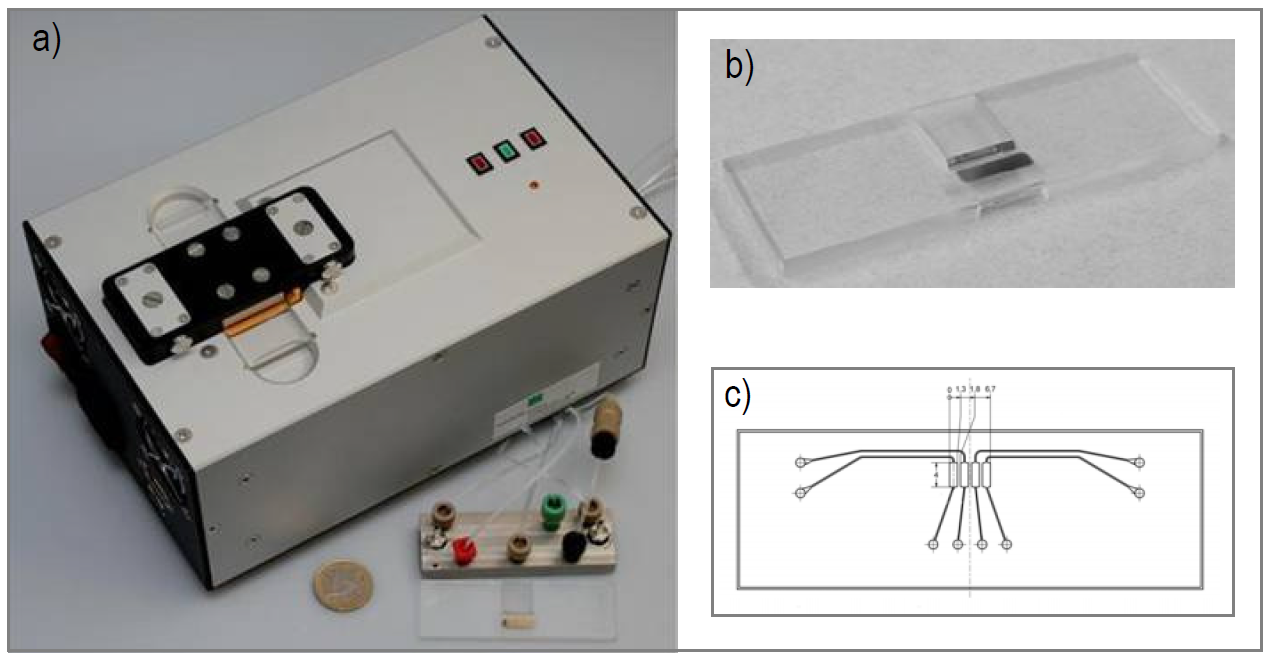
Abb. Laborprototyp des SPR-basierten Sensorsystems. a) Messgerät mit Lab-on-Chip-System, b) Sensorchip, c) On-Chip-Mikrofluidik (4-Kanal-Kontaktplatte) (Bild + Grafik: Fraunhofer IWS Dresden)
Die Abb. 7 zeigt den Laborprototyp des SPR-basierten Sensorsystems, bestehend aus dem Messgerät und dem Lab-on-Chip-System. Die prinzipielle Funktionalität des Sensorsystems unter Einsatz von Aptameren als Erkennungselemente wurde anhand eines Modell-Aptamers und seines Target gezeigt. Begleitet von der Arbeitsgruppe am Institut für Lebensmittel-und Bioverfahrenstechnik der TUD wurden mehrere Messreihen durchgeführt, wobei eine typische Bindungskurven und konzentrationsabhängige Änderung des Messsignals beobachtet werden konnte.
Ein weiteres Ziel des Projektes ist die Optimierung der Biomagnetischen Separation (BMS) zur Probenaufbereitung,durchgeführt an der TU Dresden. Bakterielle Verunreinigungen in Wässern liegen zumeist in niedrigen Konzentrationen vor, stellen aber dennoch ein Gesundheitsrisiko dar. Die im Projekt zu selektierenden Aptamere sollen dafür an Magnetischen Partikeln immobilisiert und mit der Probelösung inkubiert werden. Nach Anbinden der bakteriellen Pathogene an die Aptamere kann der gesamte Komplex magnetisch separiert werden, was eine Anreicherung der bakteriellen Pathogene aus großen Probenvolumina erlaubt. Aufbauend auf die bereits vorhandenen, umfangreichen Erfahrungen mit der BMS bestand das Ziel der Arbeiten zu diesem Themenkreis in einer wesentlichen Zeitverkürzung der Separation bei möglichst niedriger Zugabe von Magnetischen Partikeln zum Reaktionsansatz. Zu Projektbeginn wurde mit der konventionellen Abscheidemethode mit DynaMag™ magnets (Invitrogen) im Überkopfschüttler bzw. ohne aktive Durchmischung, mit E. coli als Modellkeim und SiMag-PEI-beads (Chemicell) gearbeitet. Da diese Ergebnisse, insbesondere hinsichtlich der notwendigen Menge an Magnetischen Partikeln, nicht befriedigten, entstand die Idee, einen Versuchsstand mit zwei Elektromagneten und Speicherprogrammierbarer Steuerung mit digitalen Ein- und Ausgängen zur Optimierung der Biomagnetischen Separation zu konzipieren und zu bauen. Umfangreiche Versuchsserien zeigten, dass ein Arbeiten mit dem Magnetmixer grundsätzlich möglich ist. Allerdings besteht noch Handlungsbedarf z. B. hinsichtlich der Optimierung der Wahl der Magnete und deren Anordnung, der Frequenzen, des Reaktionsvolumens, der Zellzahl und der Partikelgröße. Zu letztgenanntem Themenkreis liegen ebenfalls erste, erfolgversprechende Ergebnisse vor.
Kontakt:
Prof. Dr. Frank-Dieter Kopinke (UFZ) ![]()
![]() frank-dieter.kopinke@ufz.de
frank-dieter.kopinke@ufz.de




.png)
.png)
